Esta é a continuação do artigo sobre o sal de cozinha. Bem, nós já vimos algumas propriedades do principal componente do sal de cozinha: o cloreto de sódio. Isso mesmo, o principal componente. 99% do sal de cozinha é cloreto de sódio. O outro 1% é uma mistura de outros sais tais como: iodeto de potássio, ferrocianato de alumínio, silicato de sódio etc. Já vimos que para se obter o sal de cozinha, pode-se efetuar-se algumas reações químicas (veja a parte 1 do artigo).
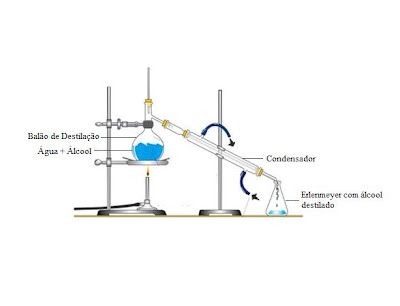
Uma segunda forma de se obtê-lo é através da água do mar. A água do mar é uma mistura de água (dã), alguns sais dissolvidos e também algumas impurezas (areia, por exemplo). Filtrando-se a água podemos retirar dela tudo o que não está dissolvido e a maior parte de suas impurezas. Feito isso, aquece-se mistura até que toda a água do sistema vaporize. Impurezas e os sais que estavam dissolvidos não evaporam com a água, obviamente. Este processo de aquecer-se a água para se obter o que está dissolvido nela se chama recristalização. Vamos esclarecer uma coisa: a ação do sol e dos ventos faz a maior parte dos sais dissolvidos na água do mar precipitarem, isto é, voltarem à forma sólida e se dirigirem ao fundo do mar. Portanto, a mistura de componentes sólidos obtida ao final da recristalização é quase o sal de cozinha que nós consumimos. Mas esta mistura é ainda enviada para refinarias que modificam sua composição para fabricar o sal de cozinha. Ou seja, através de processos industriais, a matéria retirada do mar é modificada em sua composição até ficar com 99% de cloreto de sódio e 1% de outros sais importantes. Mas as refinarias podem fabricar três tipos de sal de cozinha: sal refinado (obviamente), sal grosso e sal light. O sal refinado é aquele que consumimos todos os dias, em forma de pó. O sal grosso possui a mesma composição do sal refinado (99% de NaCl e 1% dos outros sais), só que o sal grosso não foi triturado. Já o sal light é modificado para ter 50% de cloreto de sódio e 50% de cloreto de potássio. O cloreto de potássio fica menos tempo no organismo retendo menos água consequentemente (por isso ele é mais leve, mais light). Uma outra forma de se obter cloreto de sódio é através de seu minério encontrado na natureza: a halita. Ela é extraída e processada para a obtenção do NaCl. A figura a seguir mostra o minério.

Bom, apenas 5% de todo cloreto de sódio extraído (seja da água do mar ou da halita) é utilizado na fabricação de sal de cozinha. O resto é usado para diversos fins, tais como:

- Na obtenção de sódio metálico e gás cloro - O sódio metálico é matéria prima para a substância hidróxido de sódio, a qual é utilizada nos mais variados produtos de limpeza (sabonetes, sabão em pó, detergentes etc). Já o gás cloro é utilizado principalmente como matéria prima de desinfetantes e também para a obtenção de produtos destinados à manutenção de piscinas (hipoclorito de sódio, ácido clorídrico, etc). As imagens a seguir mostram, respectivamene: sabão em pó, cloro para piscinas (feito genericamente por hipoclorito de sódio) e algicida (produto utilizado na manutenção de piscinas que contém ácido clorídrico).
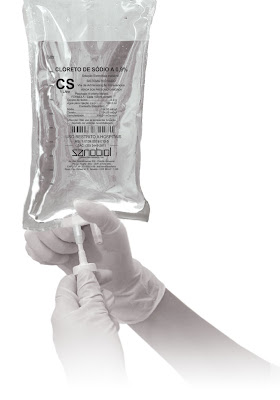
- Em cosméticos e medicamentos - Muitos dos xampus que utilizamos no cotidiano possuem em sua formulação o cloreto de sódio (o Palmolive é um bom exemplo). Você pode comprovar isto vendo o rótulo destes produtos. Lá, é possível encontrar o termo sodium chlorine que significa cloreto de sódio. Alguns remédios também possuem cloreto de sódio e neste caso a lista de produtos é imensa então só vou citar um dos mais usados: o soro fisiológico. O soro fisiológico nada mais é do que uma solução de água destilada e cloreto de sódio, onde a composição em massa do sal corresponde a 0,9% do total. Em outras palavras, se o soro "pesar" 100 gramas, 0,9 gramas são de cloreto de sódio e os outros 99,1 gramas são da água.


Estes são apenas os principais usos... O cloreto de sódio é usado para uma infinidade de coisas que vão desde à fabricação de tecidos até produtos de limpeza. Tudo isso graças ao conhecimento de suas propriedades químicas e também de alguns processos químicos. Nós vemos aí que ninguém pode dizer que a química não é importante e nem útil, não é mesmo?
Bom, é isso^^; espero que tenham gostado! Até a próxima postagem.